Easy-Load™ PCR Master Mix (Blue, 2X)
信裕生物的Easy-Load™ PCR Master Mix(Blue, 2X)是一種使用特別便捷的含有藍(lán)色染料(電泳位置約300-500bp)的2倍濃度的PCR預(yù)混液�����,含有2X Taq DNA Polymerase、2X PCR Buffer�����、2X dNTP和2X Loading Buffer�����,只需加入模板DNA�、引物和水即可進(jìn)行PCR擴增,并且擴增完畢后可以直接上樣電泳���。主要適用于cDNA或基因組DNA等的常規(guī)PCR擴增��,特別適合于定性或半定量的PCR擴增�,也可用于長度小于2kb的DNA片段的擴增和克隆�。
本產(chǎn)品永久性停止銷售,推薦選購類似產(chǎn)品:D7255 Easy-Load PCR Master Mix (Green, 2X)或D7259 Easy-Load PCR Master Mix (Orange, 2X)���。
Easy-Load™ PCR Master Mix(Blue, 2X)中已經(jīng)含有所有的通用組分,用戶只需自備引物�、模板DNA和水即可進(jìn)行PCR擴增。大大簡化了PCR操作���,使操作更加快捷���,也減少了PCR操作過程中可能導(dǎo)致的污染�����,使PCR的重復(fù)性更好�。
Easy-Load™ PCR Master Mix(Blue, 2X)可以擴增出長達(dá)8kb的片段���,但通常更適合用于擴增2kb以下的DNA片段�����。
本產(chǎn)品中加入了藍(lán)色的電泳示蹤染料�,其在濃度為1%瓊脂糖膠中的遷移位置大約位于300bp和500bp之間���。PCR結(jié)束后可直接進(jìn)行電泳檢測��,無需再添加上樣緩沖液��。藍(lán)色示蹤染料不會影響對相應(yīng)DNA條帶的觀察和檢測�。
本產(chǎn)品穩(wěn)定性高�,經(jīng)測試��,反復(fù)凍融15次后對PCR的擴增效果無顯著影響�����。反復(fù)凍融15次前后�,使用不同引物擴增100-
1500bp間不同長度目的片段的效果如圖1所示����。
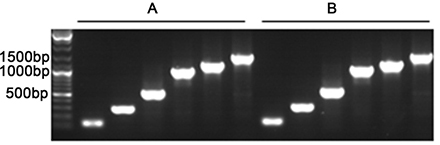
圖1. 本產(chǎn)品反復(fù)凍融15次前后擴增不同長度產(chǎn)物的效果圖。A. 反復(fù)凍融前本產(chǎn)品進(jìn)行PCR的擴增結(jié)果���。B.反復(fù)凍融15次后的本產(chǎn)品進(jìn)行PCR的擴增結(jié)果���。除本產(chǎn)品是否反復(fù)凍融15次外,A和B的反應(yīng)體系完全相同����,電泳的上樣量也相同。每毫升Easy-Load™ PCR Master Mix若用于50微升的PCR反應(yīng)體系�,足夠用于40個反應(yīng);若用于20微升的PCR反應(yīng)體系���,足夠用于100個反應(yīng)�����。
包裝清單:
XY-7251-1ml
Easy-Load™ PCR Master Mix (Blue, 2X)
1ml
XY-7251-4ml
Easy-Load™ PCR Master Mix (Blue, 2X)
1ml×4
XY-7251-20ml
Easy-Load™ PCR Master Mix (Blue, 2X)
1ml×20
XY-7251-100ml
Easy-Load™ PCR Master Mix (Blue, 2X)
1ml×100
保存條件:
-20℃保存至少一年有效�。適當(dāng)避免反復(fù)凍融���。如需頻繁使用�����,可取適量存放于4℃�,至少3天內(nèi)有效��。
注意事項:
由于PCR反應(yīng)非常靈敏�����,可使目的基因擴增超過1000萬倍����,在設(shè)置PCR反應(yīng)時請注意避免微量待擴增DNA的污染,并盡量考慮設(shè)置不加模板的空白對照以確認(rèn)是否有待擴增DNA的污染�����。
Taq DNA polymerase在PCR過程中每個循環(huán)的出錯幾率約為2.2×10-5,對于大于1kb的DNA片段的克隆推薦使用出錯幾率更低的DNA聚合酶��,例如Pfu DNA polymerase���、BeyoTaq DNA polymerase等����。對于普通的PCR或RT-PCR進(jìn)行定性或定量檢測�,Taq DNA polymerase是選擇。
盡管本產(chǎn)品經(jīng)過15次反復(fù)凍融后仍具有和凍融前幾乎相同的PCR擴增效果����,但仍宜適當(dāng)避免反復(fù)凍融本產(chǎn)品,多次反復(fù)凍融可能使產(chǎn)品性能下降�。
使用本產(chǎn)品前,一定要完全融化�����,并上下顛倒輕輕混勻后才能使用���,并盡量避免產(chǎn)生氣泡�����。
本產(chǎn)品僅限于專業(yè)人員的科學(xué)研究用�,不得用于臨床診斷或治療�����,不得用于食品或藥品�,不得存放于普通住宅內(nèi)。
為了您的安全和健康����,請穿實驗服并戴一次性手套操作。
使用說明:
- 1.PCR反應(yīng)體系的設(shè)置:
- a.室溫融解Easy-Load™ PCR Master Mix (Blue, 2X)���,上下顛倒輕輕混勻后低速離心數(shù)秒��。
- b.參考下表在冰浴上設(shè)置PCR反應(yīng)體系:
雙蒸水或Milli-Q水
-
(21-x)μl
(8.4-y)μl
引物混合物(10μM)
0.8μM
4μl
1.6μl
Easy-Load™ PCR Master Mix (Blue, 2X)
1X
25μl
10μl
- 注意:(a)通常引物的終濃度為0.2μM時可獲得良好的檢測效果���,也可以根據(jù)情況在0.1-1.0μM范圍內(nèi)調(diào)整引物的終濃度。擴增效率不高的情況下�,可提高引物的濃度;發(fā)生非特異性反應(yīng)時�,可降低引物濃度。
- (b) 對于不同類型的模板在50μl反應(yīng)體積中推薦用量如下:
- 哺乳動物基因組DNA:0.1-1μg����;大腸桿菌基因組DNA:10-100ng����;質(zhì)粒DNA:0.1-10ng����。過多的模板DNA容易導(dǎo)致非特異性的PCR產(chǎn)物。
- c.用移液器輕輕吹打混勻或輕微Vortex混勻��,室溫離心數(shù)秒��,使液體積聚于管底���。
- d.如果所使用的PCR儀有熱蓋則省略本步驟����。如果PCR儀沒有熱蓋�����,則在管內(nèi)滴入一滴礦物油(mineral oil��,ST275)。
- e.各設(shè)置好的PCR反應(yīng)管置于PCR儀上���,開始PCR反應(yīng)����。
- 2.PCR反應(yīng)參數(shù)的設(shè)置可以參考如下示例:
- STEP1(起始變性): 94℃ 3min
- STEP2(變性): 94℃ 30sec
- STEP3(退火): 55℃ 30sec
- STEP4(延伸): 72℃ 1min
- STEP5(循環(huán)): Go To STEP2 for 30 cycles
- STEP6(最終延伸): 72℃ 10min
- STEP7(臨時保存): 4℃ forever
- 注意:
- a.PCR反應(yīng)的設(shè)置需根據(jù)模板��、引物�、PCR產(chǎn)物的長度和GC含量等條件的不同設(shè)定不同的PCR反應(yīng)條件包括溫度�����、時間和循環(huán)數(shù)等�。
- b.STEP4(延伸)的時間設(shè)置需根據(jù)PCR產(chǎn)物的長度進(jìn)行設(shè)置,通常每kb產(chǎn)物的延伸時間為1分鐘���。例如PCR產(chǎn)物的長度為1kb��,則延伸時間可以設(shè)置為1分鐘�����,PCR產(chǎn)物的長度為2kb��,則延伸時間可以設(shè)置為2分鐘�,以此類推。
- c.對于初次進(jìn)行的PCR��,為盡量確??梢詳U增出預(yù)期的PCR產(chǎn)物,可以把循環(huán)數(shù)設(shè)置為35��。對于需進(jìn)行半定量或定量的PCR反應(yīng)循環(huán)數(shù)一定要進(jìn)行適當(dāng)優(yōu)化�����,使PCR反應(yīng)沒有達(dá)到平臺期���。
- 3.結(jié)果檢測:PCR結(jié)束后直接取5-10μl進(jìn)行電泳檢測�,無需添加上樣緩沖液�����。
常見問題:
- 1.PCR產(chǎn)物非常少或沒有特異性條帶�����。
- a.引物設(shè)計不佳是PCR過程中最常見的問題��。請選擇適當(dāng)?shù)囊镌O(shè)計軟件進(jìn)行引物設(shè)計,注意引物的GC含量�����、二級結(jié)構(gòu)��、二聚體��、退火溫度�����、長度��、特異性等方面的問題��。在加入酶切位點等的引物中���,一定要注意加入酶切位點等后整條引物的GC含量、二級結(jié)構(gòu)�、二聚體、退火溫度����、長度、特異性等方面的問題。在原有引物效果不佳的情況并且陽性對照引物可以正常工作的情況下�����,可以考慮更換引物�。
- b.待擴增片段GC含量偏高。GC含量較高的情況下PCR會變得相對比較困難�����,此時可以使用適合擴增高GC含量DNA片段的GC-rich buffer����,并相應(yīng)地根據(jù)GC-rich buffer的要求或說明調(diào)整PCR反應(yīng)參數(shù)的設(shè)置。
- c.長片段擴增����。盡管Taq DNA polymerase可以擴增最長達(dá)8kb的DNA片段,但大多數(shù)時候比較適合擴增2-3kb以下的片段��,更長片段的擴增推薦使用其它更適合長片段擴增的DNA聚合酶�����。
- d.PCR反應(yīng)設(shè)置時在室溫進(jìn)行容易導(dǎo)致非特異性條件�。推薦在冰浴上設(shè)置PCR反應(yīng)���。
- e.由于引物存在一定的二級結(jié)構(gòu)或存在一定的引物二聚體,或引物偏短��,導(dǎo)致退火效果不佳����。此時可以采用Touch down等方法進(jìn)行退火,通常采用從65℃逐步緩慢降溫到55℃或50℃的方法����,使退火更加充分。
- f.退火溫度不佳����,需要優(yōu)化�。如果有溫度梯度PCR儀,則可以設(shè)置退火的溫度梯度�����,摸索退火的溫度���。如果沒有溫度梯度PCR儀�����,則可以通過多次PCR反應(yīng)摸索的退火溫度�。
- g.延伸時間不足?��?砂凑彰?kb片段延伸1分鐘進(jìn)行設(shè)置��,對于較難擴增的片段可以設(shè)置為每1kb片段延伸1.5-2分鐘�。
- h.待擴增片段GC含量較高或長度較長�,變性不夠充分?���?梢哉{(diào)節(jié)起始變性條件至95℃ 1min甚至95℃ 2-4min。
- i.在不同PCR儀上進(jìn)行PCR反應(yīng)�����,避免有時PCR儀出現(xiàn)問題�����。
- j.循環(huán)數(shù)不足����,適當(dāng)延長PCR的循環(huán)數(shù)��。通常循環(huán)數(shù)最高不必超過40����,常用的循環(huán)數(shù)范圍為25-35��。
- k.模板含量太低�����,適當(dāng)加大模板量�����,或采用巢式PCR(nested PCR)或二次PCR��。巢式PCR即為在原先設(shè)計的PCR引物內(nèi)側(cè)再設(shè)計一對PCR引物��,然后對次PCR產(chǎn)物進(jìn)行稀釋后再進(jìn)行一次PCR擴增����,這樣一方面可以起到擴增作用����,同時也可以從次PCR產(chǎn)物中擴增出特異性條帶��。二次PCR則為比較簡單地用原有引物對次PCR產(chǎn)物進(jìn)行稀釋后再進(jìn)行一次PCR擴增���,可以起到擴增作用,但不能去除非特異性條帶�。
- l.模板中含有抑制PCR反應(yīng)的物質(zhì),可以用適當(dāng)?shù)腄NA純化方法例如柱純化等純化模板DNA�����。
- m.當(dāng)產(chǎn)生較多非特異性條帶時���,可以適當(dāng)提高退火溫度�。
- n.注意設(shè)置適當(dāng)?shù)年栃詫φ蘸完幮詫φ胀ǔ泻艽髱椭?/li>
關(guān)鍵字: Easy-Load? PCR Master Mix (Blue, 2X)說明書�����;Easy-Load? PCR Master Mix (Blue, 2X)廠家
上?���?道噬锟萍加邢薰臼且患壹邪l(fā)、生產(chǎn)���、銷售�����、服務(wù)于一體的一家生物科技企業(yè)�����,專營生化試劑���、標(biāo)準(zhǔn)品�����、基因����、蛋白�����、抗體�����、Elisa試劑盒�����、細(xì)胞生物學(xué)�,分子生物學(xué)等高生物產(chǎn)品?���?偛课挥谏虾#⒃诒本?��、廣東�,江西��,吉林等全國30多個省市設(shè)有分公司和代理機構(gòu)�����。涉及的產(chǎn)品被中國科學(xué)院�、清華、北大�、復(fù)旦,上海交大,復(fù)旦醫(yī)學(xué)院�����,上海中醫(yī)藥大學(xué)�,華東師范大學(xué),第二軍醫(yī)大學(xué)�����,曙光醫(yī)院��,浦東新區(qū)人民醫(yī)院等知名科研院所廣泛使用�����,可靠而穩(wěn)定的質(zhì)量和完善的售后服務(wù)確���。